(本文发布于研究所新闻http://www.qibebt.cas.cn/news/kyjz/202307/t20230708_6807549.html)
细菌的跨膜信号传导与细菌的环境感应、生长、代谢等密切相关,因而理解其跨膜信号传导机制对于细胞工厂的开发和优化具有重要的意义。青岛能源所代谢物组学研究组在研究一类感应胞外多糖和热激的调控因子SigI-RsgI时,发现RsgI具有一种全新的自酶切结构域,并通过结构、遗传和生化实验阐明了基于该自酶切的跨膜信号传导机制。发现表明在细菌中存在基于自酶切的跨膜信号传导机制,而类似的机制之前仅在真核生物中的一类G蛋白偶联受体中发现过,该成果在线发表于 Science Advances上。
SigI-RsgI因子广泛存在于厚壁菌门的梭菌纲和芽孢杆菌纲的细菌中,主要与细菌的热应激反应和致病菌的毒力相关,其中SigI属于Sigma70家族的Sigma因子,负责招募RNA聚合酶启动下游基因的转录,RsgI则属于一种新型的anti-Sigma因子,在不同条件下抑制或释放SigI的活性。大多数细菌都只含有一对SigI-RsgI因子,但热纤梭菌等可降解木质纤维素的厌氧梭菌中存在多对SigI-RsgI,负责调控高效降解木质纤维素的纤维小体。在多对SigI-RsgI中,不同的RsgI感应不同种类的胞外底物成分,并将该信号传导到胞内,释放其结合的SigI因子,从而起始转录特定的纤维小体组分。SigI和RsgI与其他的Sigma-anti-Sigma因子同源度较低,因而可能具有新型的信号传导和转录调控机制。
代谢物组学研究组长期开展纤维小体和热纤梭菌研究,针对调控纤维小体的SigI-RsgI进行了系统深入的研究。研究组前期解析的热纤梭菌中一对SigI和RsgI的抑制状态复合体结构,表明SigI-RsgI代表了一种全新的Sigma-anti-Sigma复合体类型,并揭示了RsgI对SigI的特异性抑制机制(2019 Nucleic Acids Research, https://doi.org/10.1093/nar/gkz355)。由于RsgI和已知其他类型的anti-Sigma因子没有序列同源性,其跨膜信号传导机制尚不清楚。研究组前期的序列和核磁共振分析表明,RsgI具有一个新的周质空间结构域,推测其和RsgI的信号转导有关(2015 Biomolecular NMR Assignments, http://dx.doi.org/10.1007/s12104-015-9601-7)。在此基础上,研究人员对RsgI的信号跨膜传导机制进行了系统的研究,首先发现RsgI的周质空间结构域存在断裂现象,通过无细胞翻译体系证明该断裂是一种自酶切,并通过X射线晶体学和核磁共振解析了多个RsgI周质空间结构域的结构,鉴定了自酶切的位点和可能的催化机制,发现该结构域的结构不同于已知的其他具有自酶切性质的蛋白质,是一个新的自酶切结构域类型。随后,通过热纤梭菌中的遗传操作技术,证明了该自酶切对于RsgI的跨膜信号传导是必须的,同时将RsgI从断裂位点拆分后可以激活下游信号传导,最终释放和激活处于抑制状态的SigI。通过自酶切之后的两个肽段的拆分导致下游信号激活的现象在以往的研究中只在真核生物中的黏附类G蛋白偶联受体(AGPCR)上的GAIN结构域中被发现过。研究人员又进一步通过遗传和生化技术,鉴定了RsgI信号传导第二步的膜内蛋白酶为RseP,第三步胞质蛋白酶为ClpXP,最终完整地阐明了RsgI的跨膜信号传导机制。
该研究发现了细菌中新型的跨膜信号传导机制,加深了对纤维小体底物耦联转录调控机制的理解,为热纤梭菌纤维小体的改造与应用提供了新的基础。RsgI作为感应胞外底物的关键因子,也可以为生物传感器的开发与合成生物学应用提供新的思路。
该研究由代谢物组学研究组冯银刚研究员带领完成,陈超副研究员为论文的第一作者,冯银刚为该论文的通讯作者,研究得到研究组负责人崔球研究员的指导和支持及组内成员刘亚君研究员的大力协助。复旦大学林金钟教授课题组为该研究提供了无细胞翻译体系,以色列维兹曼科学研究所Edward A. Bayer教授为该研究提供了指导和帮助。研究成果得到了国家自然科学基金、山东能源研究院、青岛市和中科院的资助。(文/陈超)
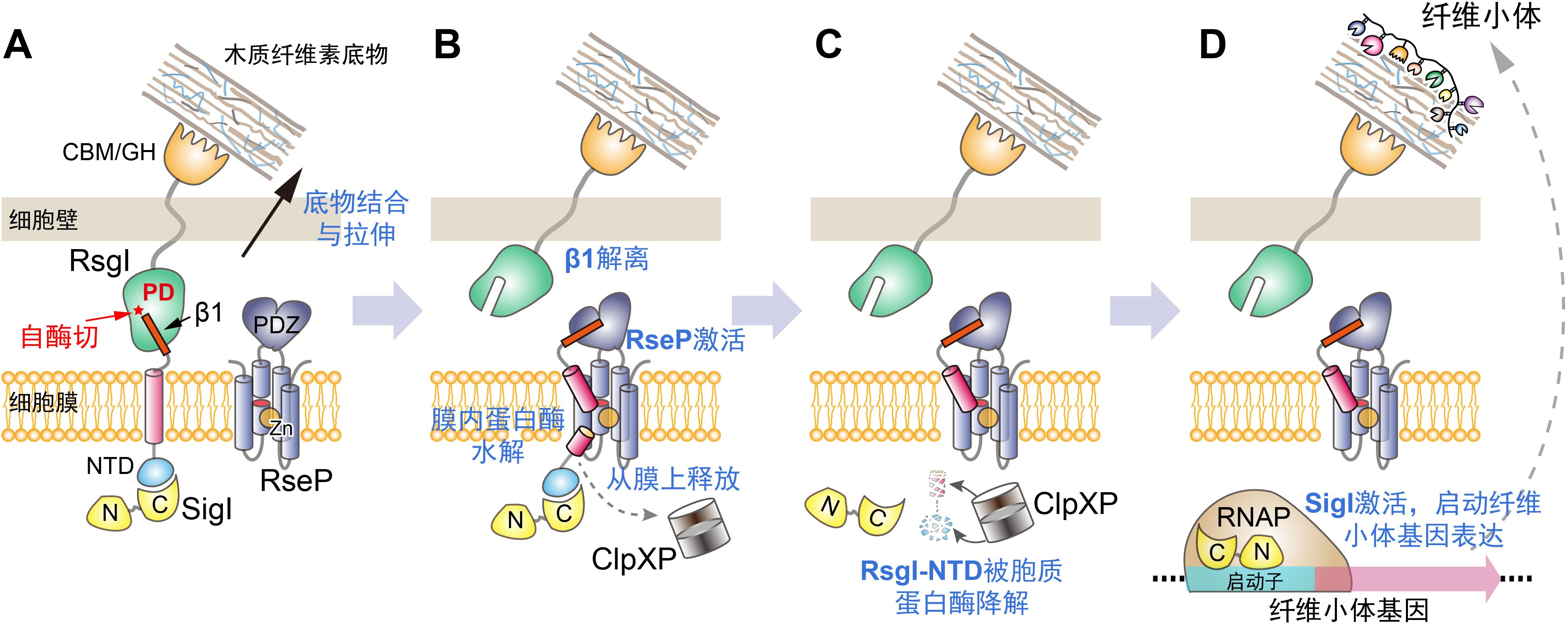
图 RsgI通过自酶切介导的跨膜信号传导机制模型。
原文链接:https://doi.org/10.1126/sciadv.adg4846
Chao Chen, Sheng Dong, Zhaoli Yu, Yichen Qiao, Jie Li, Xiaoke Ding, Renmin Li, Jinzhong Lin, Edward A. Bayer, Ya-Jun Liu, Qiu Cui, Yingang Feng* (2023) Essential autoproteolysis of bacterial anti-σ factor RsgI for transmembrane signal transduction. Sci. Adv. 9:eadg4846.